Harmonogram wprowadzania kodów UDI dla wyrobów medycznych kluczowe daty i klasy ryzyka
- Obowiązek stosowania kodów UDI wynika z Rozporządzenia MDR (UE) 2017/745 i polskiej Ustawy o wyrobach medycznych.
- Terminy wdrożenia zależą od klasy ryzyka wyrobu: Klasa III i implanty od 26 maja 2021 r.
- Dla wyrobów klasy IIa i IIb obowiązek znakowania kodami UDI wszedł w życie od 26 maja 2023 r.
- Wyroby klasy I muszą być oznakowane kodami UDI najpóźniej do 26 maja 2025 r.
- Kody UDI składają się z identyfikatora wyrobu (UDI-DI) i identyfikatora produkcji (UDI-PI), a Basic UDI-DI służy do rejestracji w EUDAMED.
- Główna odpowiedzialność za nadanie kodu UDI spoczywa na producencie, a za jego brak grożą wysokie kary pieniężne.
System UDI w pigułce: Nowy poziom identyfikacji wyrobów medycznych
Niepowtarzalny Kod Identyfikacyjny Wyrobu, czyli UDI (Unique Device Identification), to ustrukturyzowany, globalnie akceptowany system identyfikacji wyrobów medycznych. Został on wprowadzony na mocy Rozporządzenia Parlamentu Europejskiego i Rady (UE) 2017/745 w sprawie wyrobów medycznych (MDR), stanowiąc fundament dla zwiększenia przejrzystości i bezpieczeństwa w całym cyklu życia produktu.
- Poprawa bezpieczeństwa pacjentów poprzez szybką i precyzyjną identyfikację wyrobów.
- Usprawnienie identyfikowalności wyrobów medycznych od producenta, przez dystrybutora, aż po użytkownika końcowego.
- Ułatwienie i przyspieszenie procesów wycofywania produktów z rynku w przypadku stwierdzenia wad lub incydentów.
- Skuteczne zwalczanie fałszerstw i nielegalnego obrotu wyrobami medycznymi.
- Optymalizacja logistyki i zarządzania zapasami w placówkach medycznych, co przekłada się na efektywność operacyjną.
Podstawy prawne dla systemu UDI w Unii Europejskiej wyznacza wspomniane już Rozporządzenie MDR (UE) 2017/745. W Polsce natomiast, szczegółowe regulacje dotyczące wdrożenia i stosowania kodów UDI zostały zawarte w Ustawie z dnia 7 kwietnia 2022 r. o wyrobach medycznych. To właśnie te dokumenty stanowią ramy prawne, które każdy podmiot działający w branży musi bezwzględnie przestrzegać.
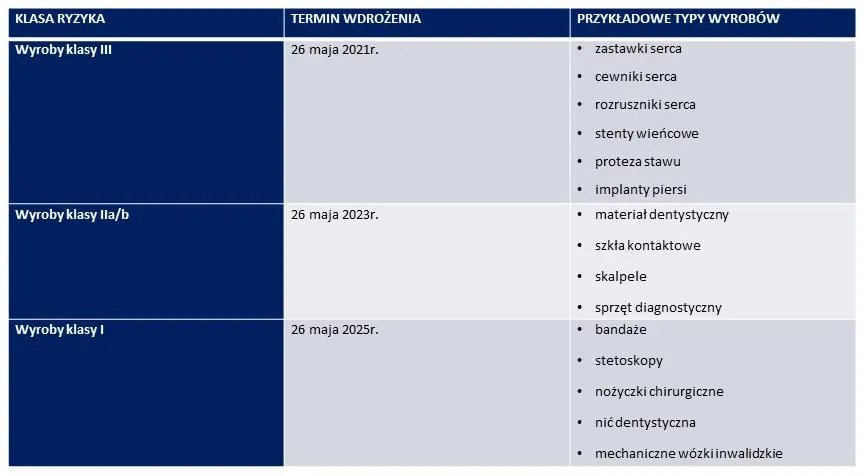
Kluczowe terminy: Kiedy kody UDI stają się obowiązkowe dla Twoich wyrobów?
Zrozumienie podstaw prawnych to jedno, ale kluczowe jest również poznanie konkretnych dat, od których obowiązkowe staje się oznakowanie wyrobów medycznych kodami UDI. Terminy te są ściśle powiązane z klasą ryzyka danego wyrobu, co ma na celu stopniowe i kontrolowane wdrożenie systemu.
Pierwsza data, którą musieliśmy zapamiętać, to 26 maja 2021 r. Od tego dnia obowiązkowe stało się oznakowanie kodami UDI wyrobów medycznych klasy III, czyli tych o najwyższym ryzyku. Do tej kategorii zaliczają się na przykład wyroby do implantacji, takie jak stenty, endoprotezy czy rozruszniki serca. Dla tych produktów, ze względu na ich krytyczne znaczenie dla zdrowia pacjentów, wdrożenie systemu UDI było priorytetem.
Kolejnym ważnym etapem był 26 maja 2023 r. Od tej daty obowiązek oznakowania kodami UDI objął wyroby medyczne klasy IIa i IIb. Mówimy tu o szerokiej gamie produktów, od cewników, przez aparaty do diagnostyki, po respiratory czy pompy infuzyjne. Wdrożenie UDI dla tych klas stanowiło duże wyzwanie dla wielu producentów, wymagające dostosowania procesów produkcyjnych i logistycznych.Ostatnim terminem w harmonogramie jest 26 maja 2025 r. To data, od której obowiązkowe oznakowanie kodami UDI obejmie wyroby medyczne klasy I, czyli te o najniższym ryzyku. Przykłady to wózki inwalidzkie, rękawice diagnostyczne, bandaże czy niektóre narzędzia chirurgiczne wielokrotnego użytku. Choć ryzyko jest mniejsze, precyzyjna identyfikacja tych wyrobów nadal ma ogromne znaczenie dla bezpieczeństwa i efektywności opieki zdrowotnej.
Warto również pamiętać, że dla wyrobów medycznych wielokrotnego użytku, które wymagają bezpośredniego oznakowania na samym produkcie (np. na narzędziach chirurgicznych), obowiązują wydłużone terminy wdrożenia. Ma to na celu umożliwienie producentom dostosowania technologii znakowania do specyfiki tych produktów, co często wiąże się z większymi wyzwaniami technicznymi.
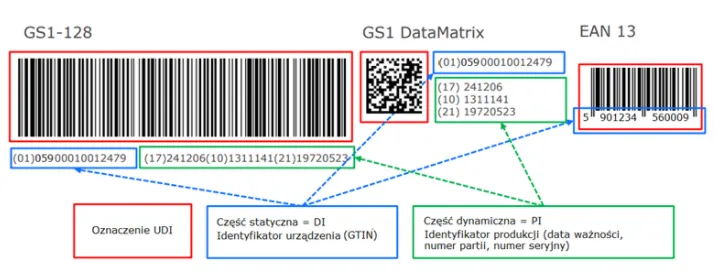
Anatomia kodu UDI: Jak poprawnie odczytać i zrozumieć oznakowanie?
Aby w pełni zrozumieć system UDI, musimy przyjrzeć się jego strukturze. Kod UDI nie jest jednolitym ciągiem znaków, lecz składa się z dwóch głównych, uzupełniających się części. Moim zdaniem, kluczowe jest rozróżnienie tych elementów, aby poprawnie interpretować dane zawarte w oznakowaniu.
| UDI-DI (Identyfikator wyrobu) | UDI-PI (Identyfikator produkcji) |
|---|---|
| Jest to stała, unikalna część kodu, która jednoznacznie identyfikuje konkretny model wyrobu medycznego oraz jego producenta. | To zmienna część kodu, która dostarcza informacji o danych produkcyjnych, takich jak numer partii, numer serii, data ważności czy data produkcji. |
Poza UDI-DI i UDI-PI, istnieje również pojęcie Basic UDI-DI. Jest to nadrzędny klucz, który służy do rejestracji wyrobu w europejskiej bazie danych EUDAMED. Basic UDI-DI nie jest umieszczany bezpośrednio na etykiecie wyrobu, ale jest kluczowy w dokumentacji, takiej jak deklaracja zgodności, certyfikaty czy podsumowanie charakterystyki bezpieczeństwa i działania (SSCP).
Wizualnie kod UDI jest przedstawiany w dwóch formatach. Po pierwsze, jako kod kreskowy (np. GS1 DataMatrix lub GS1-128), który jest czytelny maszynowo i umożliwia szybkie skanowanie. Po drugie, jako format czytelny dla człowieka (HRI Human Readable Interpretation), czyli ciąg znaków alfanumerycznych, który pozwala na odczytanie kluczowych informacji bez użycia skanera.
Warto podkreślić, że kody UDI są nadawane przez akredytowane agencje, takie jak GS1. To właśnie te organizacje odpowiadają za ustanowienie i utrzymanie standardów kodowania, zapewniając globalną spójność i unikalność identyfikatorów.
Obowiązki w łańcuchu dostaw: Kto i za co odpowiada w systemie UDI?
System UDI to nie tylko kwestia technicznego oznakowania, ale również precyzyjnego podziału odpowiedzialności w całym łańcuchu dostaw. Moje doświadczenie pokazuje, że zrozumienie tych ról jest kluczowe dla uniknięcia błędów i zapewnienia zgodności z przepisami.
Centralną rolę w procesie nadawania i umieszczania kodów UDI odgrywa producent. To on jest odpowiedzialny za nadanie kodu UDI dla każdego swojego wyrobu medycznego, umieszczenie go na etykietach i opakowaniach, a także za rejestrację wyrobu i wszystkich związanych z nim danych w europejskiej bazie EUDAMED. Jest to ogromne zadanie, wymagające precyzji i znajomości regulacji.
Również importerzy i dystrybutorzy mają swoje obowiązki. Ich rola polega przede wszystkim na weryfikacji, czy wyrób medyczny został prawidłowo oznakowany kodem UDI przez producenta. Chociaż nie nadają oni kodów, są odpowiedzialni za to, aby do obrotu trafiały wyłącznie wyroby zgodne z przepisami. Weryfikacja ta jest istotna dla utrzymania integralności łańcucha dostaw.
Nie możemy zapominać o roli placówek medycznych, takich jak szpitale czy kliniki. Mają one obowiązek zarządzania kodami UDI, zwłaszcza w przypadku wyrobów do implantacji klasy III. Dla tych produktów, placówki medyczne są zobowiązane do przechowywania (najlepiej w formie elektronicznej) kodów UDI, które im dostarczono. Umożliwia to szybką identyfikację wyrobu w przypadku konieczności jego wycofania lub monitorowania po wprowadzeniu na rynek.
Praktyczne aspekty wdrożenia systemu UDI w firmie
Wdrożenie systemu UDI w firmie to złożony proces, który wymaga starannego planowania i koordynacji. Z mojego punktu widzenia, kluczowym elementem jest rejestracja w bazie EUDAMED. Producenci muszą wprowadzić do niej szereg danych związanych z wyrobem, w tym oczywiście kod Basic UDI-DI. Proces ten jest skomplikowany i wymaga dokładności, a wszelkie błędy mogą prowadzić do opóźnień w wprowadzeniu wyrobu na rynek.
Oprócz rejestracji, niezwykle ważne jest również zarządzanie dokumentacją i przechowywanie kodów UDI. Rekomenduję wdrożenie systemów elektronicznych, które umożliwią efektywne gromadzenie, przechowywanie i wyszukiwanie danych UDI. Dobre praktyki w tym zakresie obejmują regularne audyty wewnętrzne, szkolenia personelu oraz utrzymywanie aktualnej dokumentacji procesów związanych z UDI.
Konsekwencje braku zgodności: Kary za nieprzestrzeganie przepisów
Nieprzestrzeganie przepisów dotyczących systemu UDI wiąże się z poważnymi konsekwencjami prawnymi i biznesowymi. Polska Ustawa o wyrobach medycznych przewiduje dotkliwe administracyjne kary pieniężne. Przykładowo, za nienadanie kodu UDI przez producenta, kara może wynieść do 250 000 zł. Natomiast za nienadanie kodu Basic UDI-DI, który jest kluczowy dla rejestracji w EUDAMED, grozi kara do 100 000 zł. To są kwoty, które mogą znacząco obciążyć budżet firmy i świadczą o powadze, z jaką ustawodawca traktuje te obowiązki.
Poza bezpośrednimi karami finansowymi, brak zgodności z przepisami UDI niesie ze sobą szereg szerszych ryzyk biznesowych. Może to prowadzić do wstrzymania obrotu wyrobami medycznymi, co generuje straty finansowe i logistyczne. Co więcej, utrata wiarygodności na rynku, wynikająca z niezgodności regulacyjnej, może mieć długoterminowe konsekwencje dla reputacji firmy i jej pozycji konkurencyjnej. W skrajnych przypadkach może to nawet doprowadzić do wycofania produktów z rynku i utraty zaufania ze strony klientów i partnerów biznesowych.
System UDI to nie tylko obowiązek: Korzyści dla branży i pacjentów
Chociaż wdrożenie systemu UDI wiąże się z licznymi wyzwaniami i obowiązkami, warto pamiętać, że niesie on ze sobą również znaczące korzyści, zarówno dla branży medycznej, jak i przede wszystkim dla pacjentów. Moim zdaniem, postrzeganie UDI wyłącznie jako obciążenia jest błędem to inwestycja w przyszłość i bezpieczeństwo.- Zwiększone bezpieczeństwo pacjentów: Precyzyjna identyfikacja wyrobów minimalizuje ryzyko błędów medycznych i umożliwia szybsze reagowanie na incydenty.
- Lepsza identyfikowalność produktów: UDI pozwala na śledzenie wyrobu od momentu produkcji aż po jego użycie, co jest nieocenione w przypadku konieczności wycofania produktu z rynku.
- Usprawnienie logistyki w placówkach medycznych: Automatyczne skanowanie kodów UDI ułatwia zarządzanie zapasami, redukuje błędy w inwentaryzacji i optymalizuje procesy magazynowe.
- Skuteczniejsze zwalczanie fałszerstw: Unikalne kody utrudniają wprowadzanie na rynek podrobionych lub nielegalnych wyrobów medycznych, chroniąc zarówno pacjentów, jak i uczciwych producentów.
- Lepsza analiza danych: Gromadzenie danych UDI w bazach takich jak EUDAMED umożliwia dogłębną analizę trendów, incydentów i efektywności wyrobów, co przyczynia się do ciągłego doskonalenia produktów.

